Mariana Dalaqua
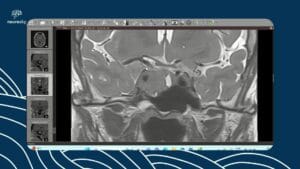
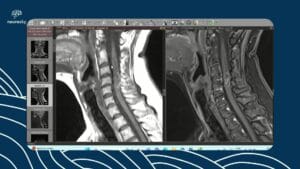
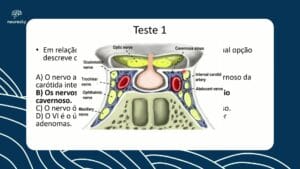
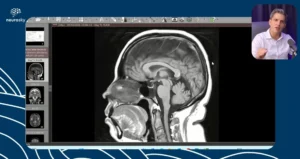
Neurossarcoidose: da investigação clínica ao tratamento
- Sem Comentários
- Categorias: AVC, Desmielinizantes e Autoimunes, Infecções, Intermediário, Podcasts, Premium
- Tags: #autoimune, #neurossarcoidose, #sarcoidose
0
0
votos
Classifique o conteúdo
Inscreva-se
Login
Faça o login para comentar
0 Comentários
Mais antigos
Mais novos
Mais votados
Inline Feedbacks
Ver todos os comentários